Az orvosi ágyakat orvosi ágynak, orvosi ágynak, ápolóágynak stb. is nevezhetjük. A betegek által kórházi kezelés során használt ágyak. Főleg nagyobb kórházakban, települési egészségügyi központokban, közösségi egészségügyi szolgáltató központokban stb. használják.
Az Egyesült Államok FDA előírja, hogy amikor élelmiszerek és gyógyászati termékek belépnek az Egyesült Államok piacára, azokat regisztrálniuk kell az Egyesült Államok FDA hivatalos webhelyén, mielőtt belépnének az Egyesült Államok piacára.
A kórházi ágyak az FDA I. osztályú orvosi eszközei közé tartoznak. Az Egyesült Államok Élelmiszer- és Gyógyszerügyi Hatósága az I. osztályú eszközöket úgy határozza meg, hogy „nem életfenntartásra vagy életfenntartásra szolgálnak, vagy nem fontosak az emberi egészség károsodásának megelőzésében, és nem jelenthetnek potenciális „Eszközök, amelyek indokolatlan betegség- vagy sérülés." Ezek az eszközök az FDA által szabályozott készülékek leggyakoribb kategóriája, amelyek a piacon lévő jóváhagyott eszközök 47%-át teszik ki. Az I. osztályú eszközök minimálisan érintkeznek a pácienssel, és minimális hatással vannak a beteg általános egészségi állapotára. Az I. osztályú készülékek jellemzően nem érintkeznek a páciens belső szerveivel, központi idegrendszerével vagy szív- és érrendszerével. Ezekre az eszközökre minimális szabályozási követelmények vonatkoznak.
Az orvostechnikai eszközök FDA-tanúsítványa magában foglalja: gyártói regisztrációt az FDA-nál, termék FDA-regisztrációt, terméklista regisztrációt (510-es űrlap regisztráció), terméklistát (PMA felülvizsgálat), címkézést és műszaki átalakítást, vámkezelést, regisztrációt és forgalomba hozatal előtti jelentést az egészségügyi és egészségügyi eszközök, A következő anyagokat kell benyújtani:
(1) Öt példány teljesen becsomagolt késztermékből
(2) Az eszköz szerkezeti diagramja és szöveges leírása
(3) A készülék teljesítménye és működési elve
(4) Az eszköz biztonsági bemutatója vagy vizsgálati anyagai
(5) Bevezetés a gyártási folyamatba
(6) A klinikai vizsgálatok összefoglalása
(7) A termékre vonatkozó utasítások. Ha az eszköz radioaktív tulajdonságokkal rendelkezik, vagy radioaktív anyagokat bocsát ki, azt részletesen ismertetni kell.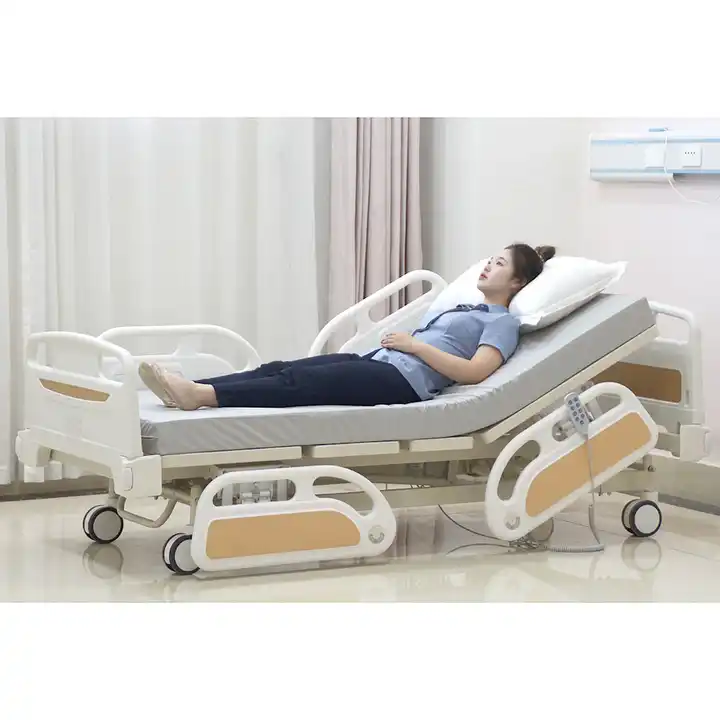
Projektciklus
Az FDA értékelésétől a végső jóváhagyásig általában hosszabb idő telik el, és azt az FDA szabályozza; általában a teljes normál folyamatciklus körülbelül 12 hónap
A kórházi ágyak 510K jelentkezési folyamata a következő:
1. Az FDA 510(K) műszaki dokumentum megfelelőségi követelményei
2. Az Egyesült Államok FDA 510k regisztrációjára vonatkozó szabványos elemzés
3. Meglévő dokumentumok elérhetőségének megerősítése
4. A piacon lévő regisztrált termékek összegyűjtése és összehasonlítása
5. Készítse el a termékinformációkat az Egyesült Államok FDA 510k követelményeinek megfelelően
6. Készítsen 510 ezer regisztrációs okmányt a szabványoknak megfelelően
7. A regisztrációs dokumentumok felülvizsgálati eredményei alapján végezzen revíziókat
8. Töltse ki a cégbejegyzést és a terméklista regisztrációját
A taishaninc globális exporttanúsítvánnyal rendelkezik
5 100%-os tulajdonú leányvállalata van
Lefedi az építőanyag-, vegyi- és orvostechnikai eszközök iparát
Globális exporttanúsítvánnyal rendelkező gyár vagyunk, éves termelési értéke 5 000 000 USD, és a világ több mint 160 országába exportálunk. Mi vagyunk a legnagyobb integrált ipari park gyár a környéken. Ha szükséges, kérjük, időben vegye fel velünk a kapcsolatot és küldje el a részletes termékinformációkat.
Feladás időpontja: 2023. november 21




